骨质疏松症(OP)是一种以骨量降低、骨组织微结构破坏,导致骨脆性增加、骨强度下降,易发生骨折为特征的全身性代谢骨病。骨质疏松症已被世界卫生组织列为仅次于心血管疾病的第二大危害人类健康的疾病,被称为“沉默的杀手”。相关研究报告显示,中国是世界上骨质疏松症患者最多的国家,约有9000万人罹患此病,其发病率与年龄息息相关。OP的危害主要为易发骨折、骨质疏松性骨折导致的残疾、心肺功能障碍等,极大地影响老年人生活质量。
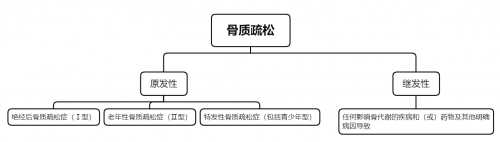
图1. OP的分类
动物模型选择选择与骨质疏松症(OP)的分类
OP发病受多重因素影响,包括遗传、激素、营养、年龄、生活习惯及免疫学等。临床常见的OP根据病因可分为原发性、继发性两大类[1]。而原发性OP是临床最常见的类型(约占80%),又分为 Ⅰ 型高转换型OP(以骨吸收增加为主,常见于绝经后女性)、Ⅱ 型低转换型OP(以骨形成减少为主,常见于老年人)以及特发性OP(包括青少年型)。
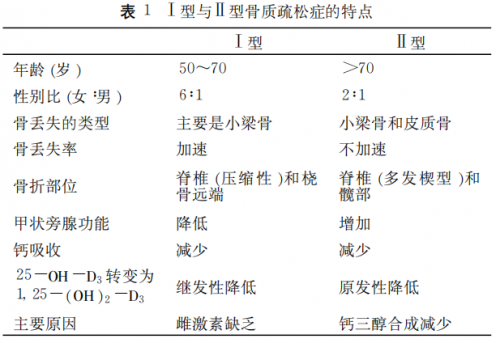
表1. Ⅰ型与Ⅱ型OP的特点[1]
常见的骨质疏松症OP模型构建方式:
关于OP的研究(发病机制、药物筛选、防治手段等)都离不开动物模型的构建和应用[2]。由于OP发病机制较为复杂、药物作用机制与作用靶点不同,因此抗骨质疏松症药物药效学研究过程中动物模型的选择有所不同。
构建骨质疏松症原则:
理想的OP模型至少需要符合以下几点[3]:
一是简便,即建模方法简单,周期短,建模过程具有较强的可控性和可操作性;
二是经济,即建模费用适中,可大批量应用;
三是相似性好,能较好地模拟OP发生和发展的过程。
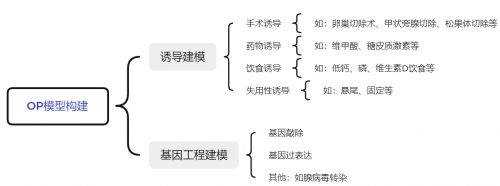
图2. OP模型构建方式
构建骨质疏松症两种方法:
经过长期实践探索,OP 研究中模式动物种类繁多,造模方法可概括为诱导建模和基因工程建模两类。
1、诱导建模
诱导建模根据诱导原理和方式的不同可分为手术诱导https://www.gempharmatech.com/produce/model/10.html(卵巢切除术、甲状旁腺切除、松果体切除等)、药物诱导(如维甲酸、糖皮质激素等)、饮食诱导(如低钙、磷、维生素D饮食等)、失用性诱导(如悬尾、固定等)等。
2、基因工程建模
基因工程动物https://www.gempharmatech.com/technology/customization.html主要包括基因敲除模型(全身性敲除、条件性敲除)、基因过表达模型以及腺病毒转染等方式构建的其他模型[4]。
集萃药康OP模型资源-代繁骨质疏松动物模型小鼠品系种类:
集萃药康深耕模式动物领域多年,拥有丰富的模型构建经验,并自主建立了肿瘤、代谢、自免、神经等药理药效平台,可提供临床前的体内、外药效评价服务。为助力骨质疏松相关药物研发,集萃药康通过基因编辑、手术诱导等方式构建了多种骨质疏松OP模型https://www.gempharmatech.com/produce/model/221.html,满足不同药物评价需求。
1、基因编辑的自发OP模型
人体骨组织处于不断重建中,成骨细胞骨形成与破骨细胞骨吸收之间的联系是骨代谢平衡的必要条件,而骨保护素(OPG)/核因子κβ受体活化因子(RANK)/核因子κβ受体活化因子配体(RANKL)信号通路是成骨细胞与破骨细胞之间通讯的重要桥梁[5]。
RANKL(TNFSF11)是TNF超家族成员,参与免疫调节及骨代谢(形成/吸收),是破骨细胞分化及成熟的重要激活因子。RANKL通过与RANK结合在调控破骨细胞的形成及其在骨重建中发挥重要作用。而OPG通过与RANKL结合,阻断RANK与RANKL结合,从而抑制骨吸收,维持骨代谢平衡[5-6]。因此,过表达RANKL或下调OPG水平可能会导致破骨细胞过度活化而出现OP。
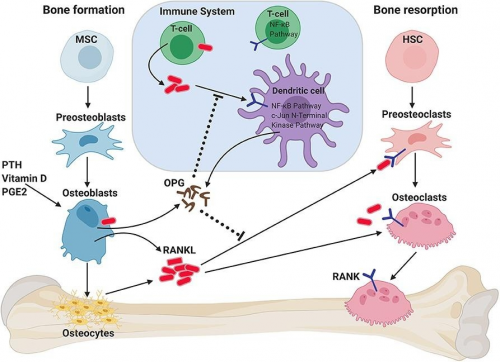
图3. OPG/RANK/RANKL在骨稳态中的作用[7]
OPG/RANK/RANKL信号系统除调节骨代谢平衡外,也参与细胞增殖、血管硬化、肿瘤骨转移、炎症和骨免疫等多种生理生化过程[8]。因此,靶向OPG、RANKL等靶点开发治疗骨质疏松及其他骨代谢疾病治疗药物具有重要意义。
集萃药康采用BAC转基因技术https://www.gempharmatech.com/produce/model/31.html制作了携带完整人类RANKL基因的B6-hRANKL转基因小鼠模型https://www.gempharmatech.com/shop/detail/7411.html,可自发出现骨质疏松症状。集萃药康进一步将B6-hRANKL-Tg转基因小鼠与mOPG-KO小鼠配繁,获得了B6-hRANKL-mOPG+/-模型,RANKL的过表达和OPG的下调使得该模型表现出更加严重的骨质疏松表型,可用于评价靶向人RANKL的抗骨质疏松药物的疗效。
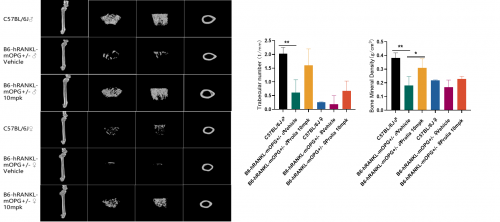
图4. 基于B6-hRANKL-mOPG+/-小鼠的体内药效试验
Micro CT影像图结果显示:与野生型小鼠相比,B6-hRANKL-mOPG+/-小鼠的骨小梁数量减少,骨密度降低,抗人类RANKL抗体(Prolia / Denosumab)干预后,B6-hRANKL-mOPG+/-小鼠的骨小梁数量增多,骨密度增高,表型得到很好改善。
2、去卵巢法构建OP模型
去卵巢造模法是将适龄雌鼠通过手术去势,用于模拟人类女性绝经后雌激素水平降低引发的骨质疏松。雌激素是维持骨代谢平衡的重要物质之一,可通过OPG/RANK/RANKL途径直接作用于破骨细胞,促使破骨细胞凋亡、抑制破骨细胞分化、成熟,从而使骨吸收减少[9]。另外,雌激素通过改变转录因子的活性,调节自噬,减弱氧化应激反应,降低核因子κB(nuclear factor kappa-B,NF-κB)活性,降低骨硬化蛋白,抑制成骨细胞凋亡并增加成骨细胞的存活时间,从而影响骨代谢。因此雌激素缺乏可引起骨代谢失衡,导致骨量减少或骨质疏松[10]。去卵巢造模法可以降低雌鼠体内雌激素水平,模拟女性绝经后骨质疏松。一般,将小鼠卵巢摘除后正常饮食8~12周,即可建立骨质疏松模型。
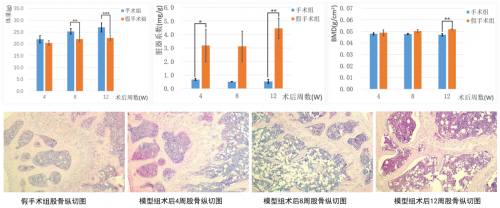
图5. 卵巢切除的小鼠OP模型表型观察
12周雌鼠摘除卵巢12周后的体重明显高于假手术组,小鼠卵巢摘除后子宫的脏器系数显著降低,骨密度显著降低。取小鼠股骨进行HE染色,结果显示模型组相比于假手术组,大体上股骨骨组织的骨小梁边缘粗糙,骨小梁间隙增大,骨小梁排列不齐且有断点,骨髓腔内空泡增多。
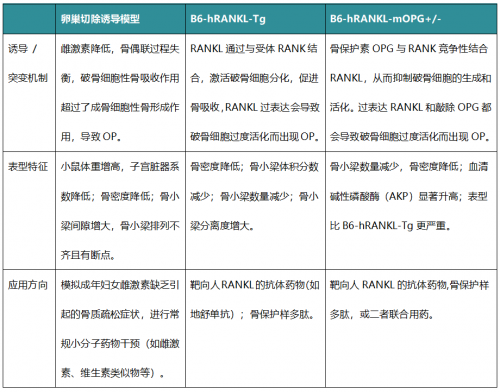
OP模型比较
参考文献:
李险峰. 骨质疏松症的分类和分型. 中国全科医学. 2005, (16).
薛丽香, 张凤珠, 孙瑞娟, 等. 我国疾病动物模型的研究现状和展望. 中国科学: 生命科学, 2014, 44(9) : 851-861.
孙凯, 魏戌, 朱立国, 等. 病证结合模式下骨质疏松症实验动物模型的研究进展. 中国骨质疏松杂志, 2019, 25 ( 9) :1340-1344.
江瑞雪, 蒋欣泉, 文晋. 骨质疏松动物模型研究现状与进展. 中国骨质疏松杂志. 2022, 28(07).
李小娜. OPG/RANK/RANKL信号通路研究进展.河南医学研究, 2014.
Rinotas, Vagelis, et al. Novel genetic models of osteoporosis by overexpression of human RANKL in transgenic mice. Journal of Bone and Mineral Research 29.5 (2014): 1158-1169.
Jie Ming, Shane J F Cronin, Josef M Penninger. Targeting the RANKL/RANK/OPG Axis for Cancer Therapy. Front Oncol. 2020 Aug 7;10:1283.
屈晓龙, 蒋涛. OPG-RANKL-RANK信号系统与骨质疏松治疗的研究进展. 生命科学. 2018, 30(07).
Hadji P, Colli E, Regidor PA. Bone health in estrogen-free contraception[J]. Osteoporos Int, 2019, 30(12): 2391-2400.
Gavali S, Gupta MK, Daswani B, et al. Estrogen enhances human osteoblast survival and function via promotion of autophagy. Biochim Biophys Acta Mol Cell Res, 2019, 1866(9): 1498-1507.
本文地址:http://www.chinaxhk.net/jiankang/40434.html - 转载请保留原文链接。| 免责声明:本文转载上述内容出于传递更多信息之目的,不代表本网的观点和立场,故本网对其真实性不负责,也不构成任何其他建议;本网站图片,文字之类版权申明,因为网站可以由注册用户自行上传图片或文字,本网站无法鉴别所上传图片或文字的知识版权,如果侵犯,请及时通知我们,本网站将在第一时间及时删除。 |